0 引 言
能源是人类赖以生存和发展的重要物质基础。目前,世界上使用的大部分能源来自化石燃料,但矿物能源的不可再生性和严重的环境污染问题已经成为人类社会面临的巨大危机[1-2]。为了满足低碳经济的能源需求,煤层气开发受到广泛关注,而生物煤层气是煤层气资源的重要组成部分。
生物成因煤层气是煤中大分子有机质经特定微生物降解转化为可溶性有机质[3-5](长链脂肪酸、烷烃、低分子量芳烃等),然后继续被降解成乙酸、H2和CO2等小分子,最后被不同产甲烷菌群利用生成甲烷[6-8]。虽然温度、盐度、pH值、Eh值和微量元素含量对煤的微生物厌氧降解体系影响已被国内外研究学者所证实[9-11],但煤阶是影响煤生物产气实验室研究的前提。STRAPOC等[12]假设生物CH4的生成潜力与煤阶增加之间存在负相关关系,他们将这一结论归因于高阶煤含有较高的芳香烃含量。宋金星等[13]探讨了不同煤阶煤的显微组分与生物甲烷代谢之间的联系,发现煤中H/C比与生物产气效率具有一致性。WAWRIK等[14]报告称,生物CH4生成潜力和煤阶之间没有相关性,并得出结论认为,煤的活化和较强的微生物群落结构是生物CH4生成的主要因素。
国内外学者对生物成因煤层气生成的液相成因机理已经有了较深入的研究。陈林勇等[15]研究了无烟煤生物产气不同阶段发酵液中液相产物的变化特征,认为挥发性脂肪酸(VFA)和长链烷烃在煤生物产甲烷过程中发挥中重要的作用。赵同谦等[16]探讨了煤生物产气过程中有机液相产物的变化特征,得出发酵液中TOC含量的变化周期与产气时期具有一致性。XIA等[17]发现煤样通过白腐菌预处理后可增加中间液相有机物(包括二十七烷、乙酸、丁酸、酰胺类等)的生成量,同时水解期明显缩短。煤制生物甲烷液相成因机理研究中发酵底物较为单一,对不同煤阶煤生物降解过程液相产物对比还没有形成共识。
微生物吸附是由其表面结构以及物理性质决定的[18-19]。微生物因其表面特有的有机大分子结构(蛋白质、脂多糖等),使其能吸附于煤表面[20]。同时,煤的多孔结构和粗糙基质也有助于微生物的吸附[21]。微生物生物膜是动态的、复杂的、非随机的结构[22-23],煤与细菌之间的养分转化需要生物膜,如果生物膜在煤表面形成,它们可能是释放和转化有机物的宿主生物。有学者研究结果表明,表面活性剂可以改变煤颗粒表面性质,增加细菌在煤颗粒表面的吸附能力,并促进生物膜的形成,从而利用微生物提高煤层气产量的关键[24-25]。
基于煤的生物产气潜力与煤阶的耦合关系,众多研究均从煤结构的分析角度入手,鲜有关注不同煤阶煤生物产气过程中发酵液液相产物变化规律以及菌群附着特征与甲烷产量之间的协同效应。因此,本文用液相分析结果与扫描电镜测试,来反映不同煤阶煤样厌氧生物降解过程中生物甲烷出现差异的可能性原因,为煤的清洁利用提供借鉴。
1 不同煤阶煤的生物产气试验
1.1 试验材料
分别在山西麻家梁煤矿、山西沙曲煤矿和河南平顶山煤矿采集新鲜的长焰煤、焦煤和瘦煤作为试验煤样,工业分析和元素分析分别按照国家标准GB/T 30732—2014和GB/T 31391—2015进行,测试结果见表1。试验前将煤样放入60 ℃的烘干箱中烘干24 h(为了去除煤样水分以及残余气),然后将其粉碎至60~80目(0.2~0.3 mm),并在35 ℃下干燥24 h,密封保存。
表1 煤样的工业分析与元素分析
Table 1 Proximate analysis and ultimate analysis of coal samples %

煤样工业分析 元素分析MadAadVdafFCadCHONS长焰煤2.7110.9327.8558.5173.294.9819.291.061.38焦煤2.037.7624.1866.0379.424.0213.811.321.43瘦煤4.2311.4913.2970.9981.673.8912.411.780.25
1.2 生物产气试验
试验所用产甲烷菌菌种由各个矿井井口排采水经过富集、驯化培养得到。在500 mL锥形瓶中加入15 g煤样、200 mL水、70 mL培养基和30 mL菌液,营养液具体准备方式见文献[26]。
设置3种煤样的生物产气试验,每组3个平行样。3组发酵试验均在35 ℃下恒温培养箱中进行,采用排水集气法每隔5 d进行气体含量测试,甲烷定量分析使用气相色谱仪(Agilent 7890GC)。同时采集3种发酵试验第0天、第10天、第15天、第20天和产气终止阶段(第30天)的发酵液,供后续液相有机物成分测定。
1.3 有机物成分测定
采用以下GC-MS条件对发酵液进行分析:美国安捷伦(GC-MS 7890-5977A气相色谱仪/质谱仪),配有游离脂肪酸相(FFAP)色谱柱(30 m×0.25 μm×0.5 mm)和国家标准与技术研究所(NIST)2014数据库。测定条件为:载气为99.999%的高纯氦气,载气流速为30 mL/min;柱温采用程序升温至50 ℃,保持1 min,以15 ℃/min升至120 ℃,以5 ℃/min升至170 ℃,保持5 min,再以15 ℃/min升至240 ℃,保持3 min。
1.4 扫描电镜检测
按照前人的研究进行固定溶液与磷酸缓冲液的配制。扫描电镜样品制备:发酵后煤样在固定溶液中浸泡2 h,之后用磷酸缓冲液清洗4次,然后进行乙醇梯度脱水:25%、50%、75%、95%乙醇各浸泡十次,每次时间为20~30 min,之后用100%乙醇浸泡3次,每次时间为1 h。最后样品在35 ℃烘干箱中进行干燥处理。用Edwards S 150B溅射镀膜机对样品进行1 min的金溅射,并用捷克Tescan公司VEGA TS 5136 XM扫描电子显微镜进行观测[27]。
100 mL的1 mol/L磷酸钠缓冲液(pH=7.2)的配制:添加6.8 mL浓度1 mol/L NaH2PO4,用1 mol/L Na2HPO4调整pH,直到pH为7~7.2,用灭菌好的去离子水至100 mL。
100 mL的固定溶液制备:分别添加50 mL 4%多聚甲醛、8 mL 25%戊二醛、20 mL上述磷酸钠缓冲液和22 mL灭菌后的去离子水。
2 结果与讨论
2.1 生物产气量分析
不同煤阶煤的生物产气累积产气量、甲烷浓度与甲烷产量进行了研究,结果如图1所示。可以看出,生物产气总量与煤阶成反比,煤阶越高,生物产气总量越低,并且低煤阶煤的生物甲烷产量明显高于高煤价煤,说明低阶煤更适合作为生物成气的底物。
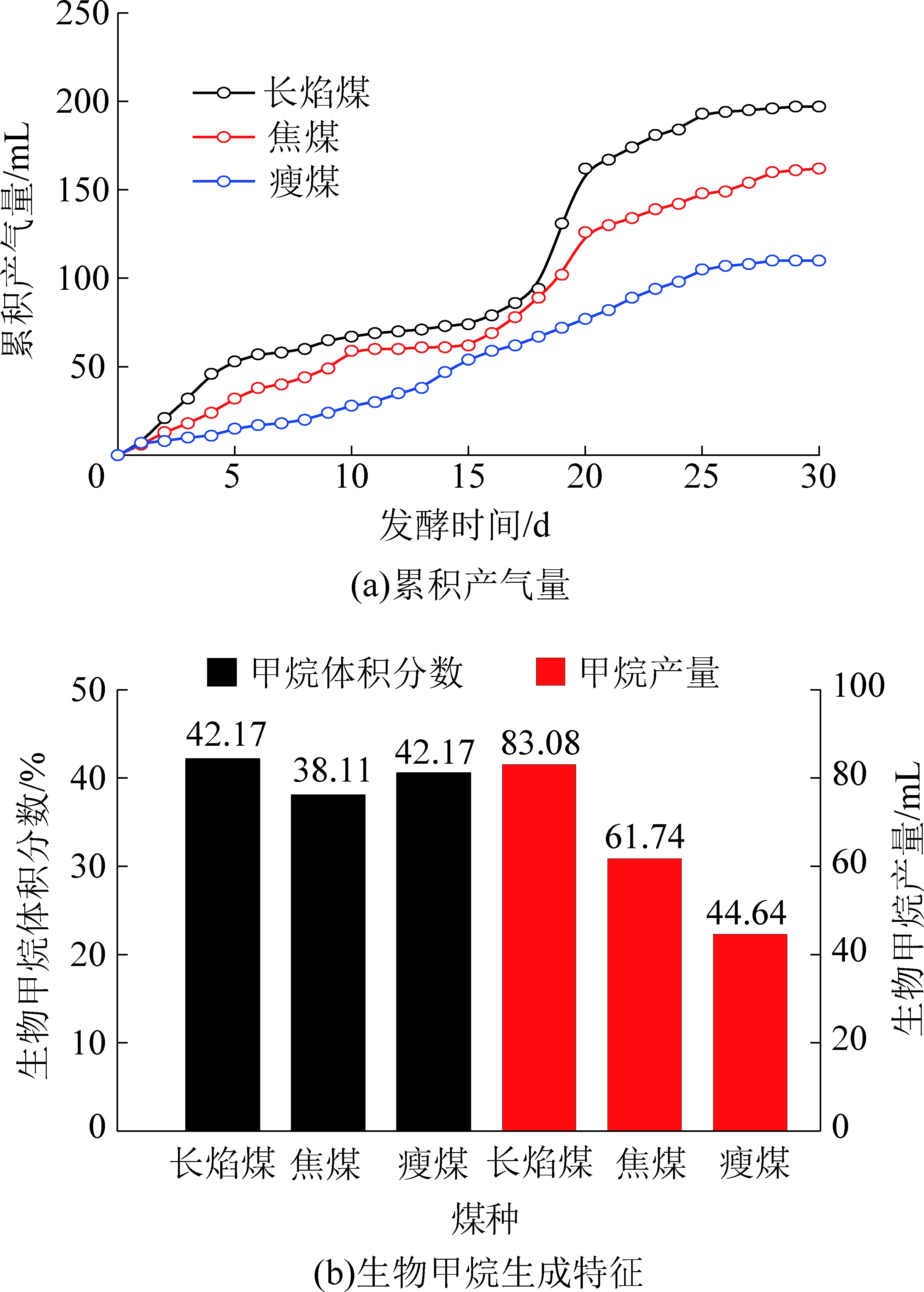
图1 累积产气量与甲烷产量变化特征
Fig.1 Change characteristics of cumulative biogas and methane production
煤阶不同,产气阶段也有所差异。煤阶越低,煤的生物产气3个阶段越明显,第1阶段:缓慢增长→快速增长;第2阶段:快速增长→缓慢增长;第3阶段:缓慢增长→产气停止。对煤生物成气有利的第2阶段:长焰煤的第2阶段是7~22 d,瘦煤的第2阶段是15~22 d,相对长焰煤持续时间较短,焦煤的生物成气反应较为平缓,没有明显的大幅上升阶段。
2.2 液相产物分析
每组试验制作5个平行样,分别在5、15、20和30 d取50 mL发酵液(充分摇匀后提取),进行离心处理,离心速度:9 000 r/min,离心机温度:10 ℃。离心后取上清液进行GC-MS测试,图2、图3和图4所示,表2、表3和表4列举了对应图中峰号所对应的化合物。
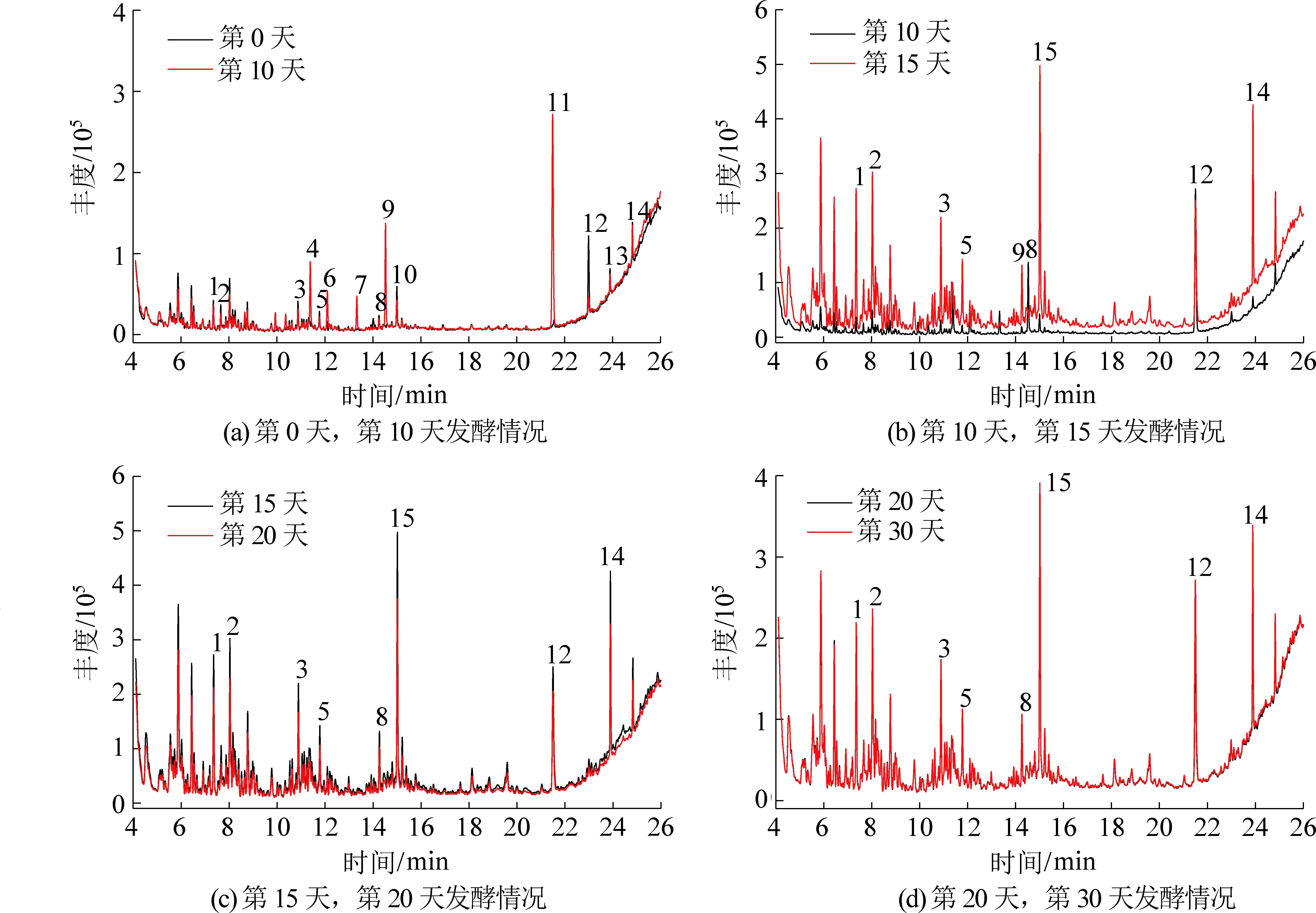
1,…,14—峰号
图2 长焰煤厌氧发酵过程中GC-MS谱图
Fig.2 GC-MS chromatogram in process of anaerobic fermentation for long flame coal
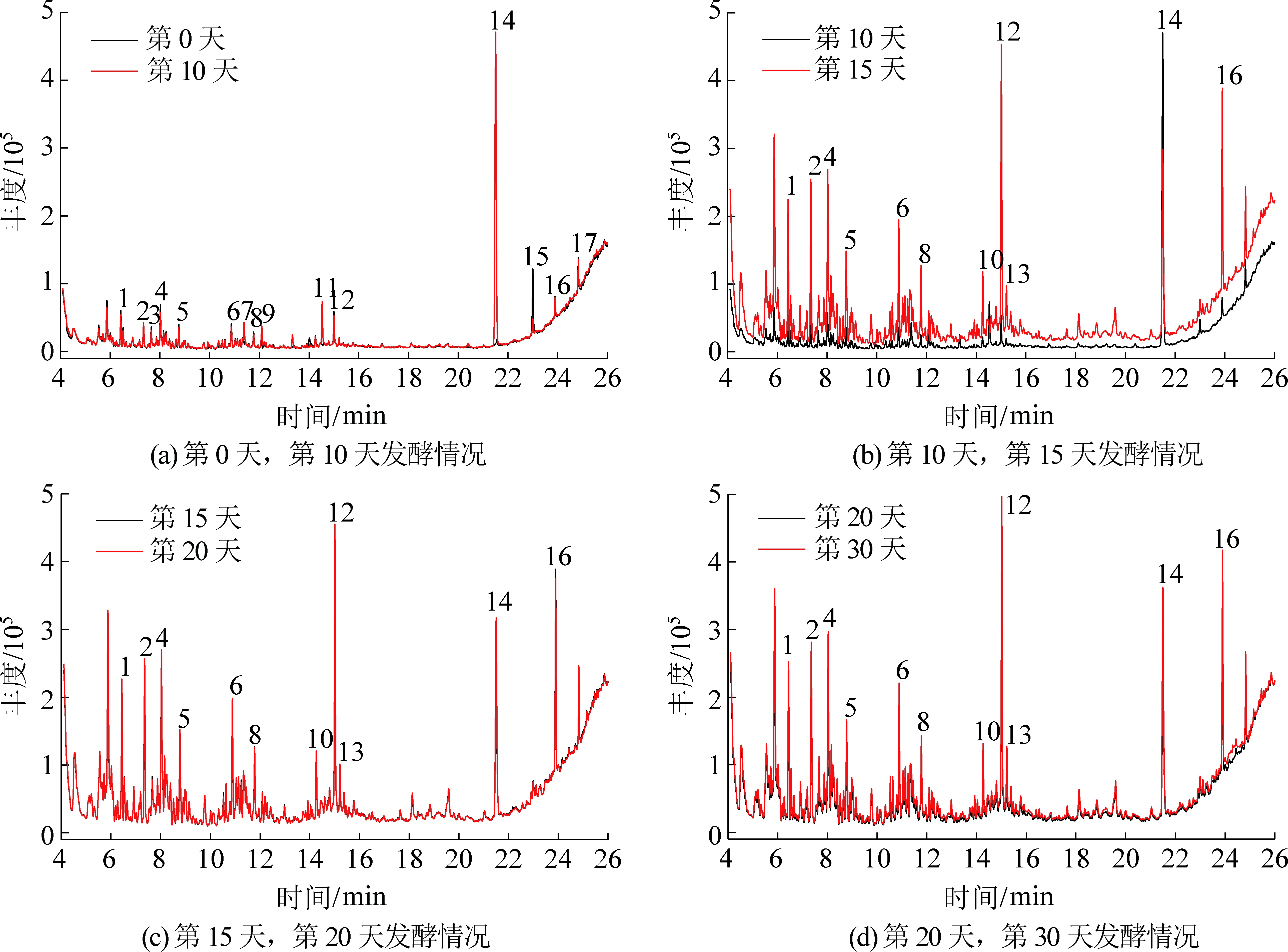
1,…,14—峰号
图3 焦煤厌氧发酵过程中GC-MS谱图
Fig.3 GC-MS chromatogram in process of anaerobic fermentation for coking coal
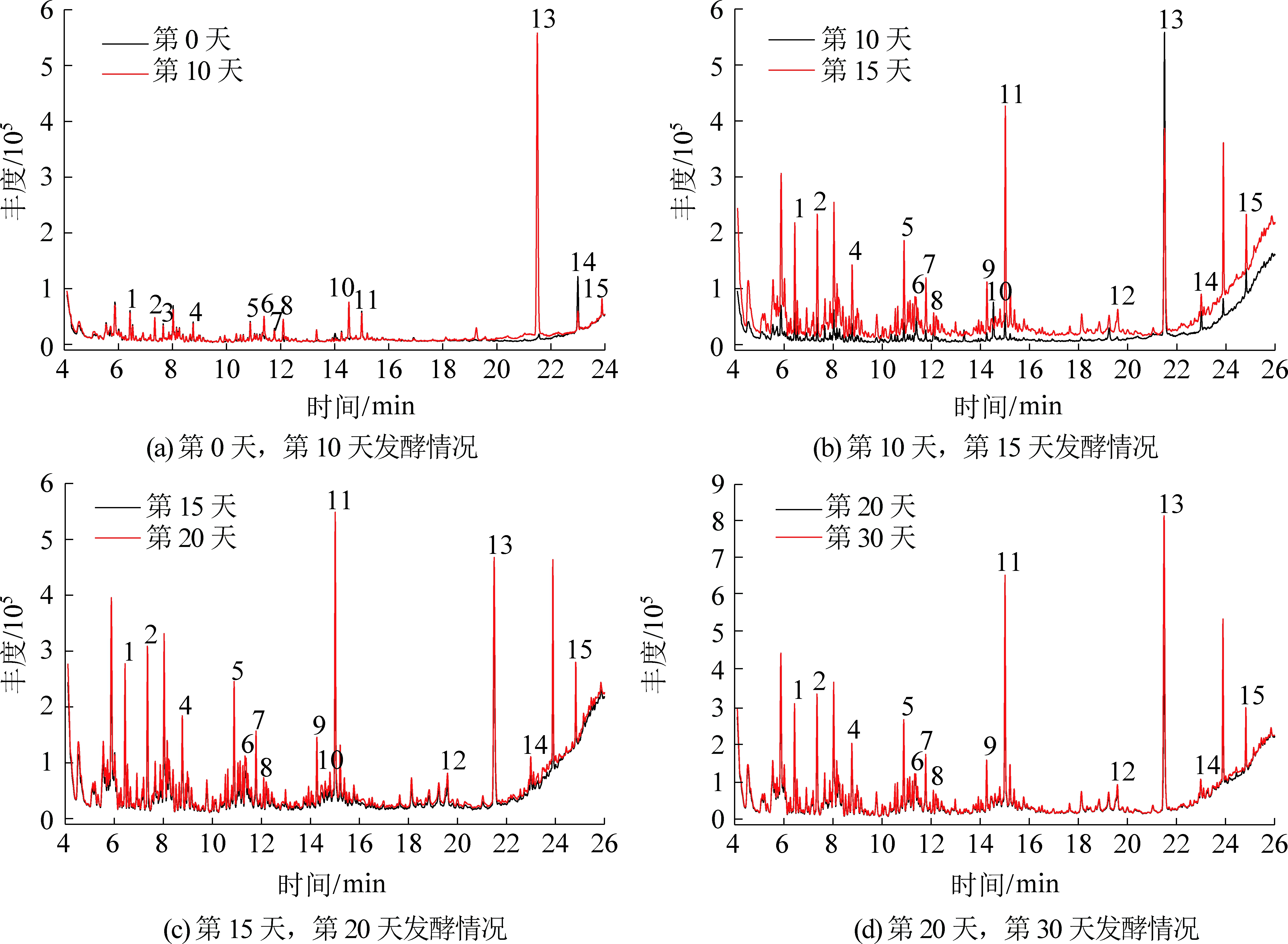
1,…,14—峰号
图4 瘦煤生物制气发酵液GC-MS谱图
Fig.4 GC-MS chromatogram in process of anaerobic fermentation for lean coal
表2 长焰煤厌氧发酵过程中GC-MS半定性结果汇总
Table 2 GC-MS qualitative results in process ofanaerobic fermentation for long flame coal
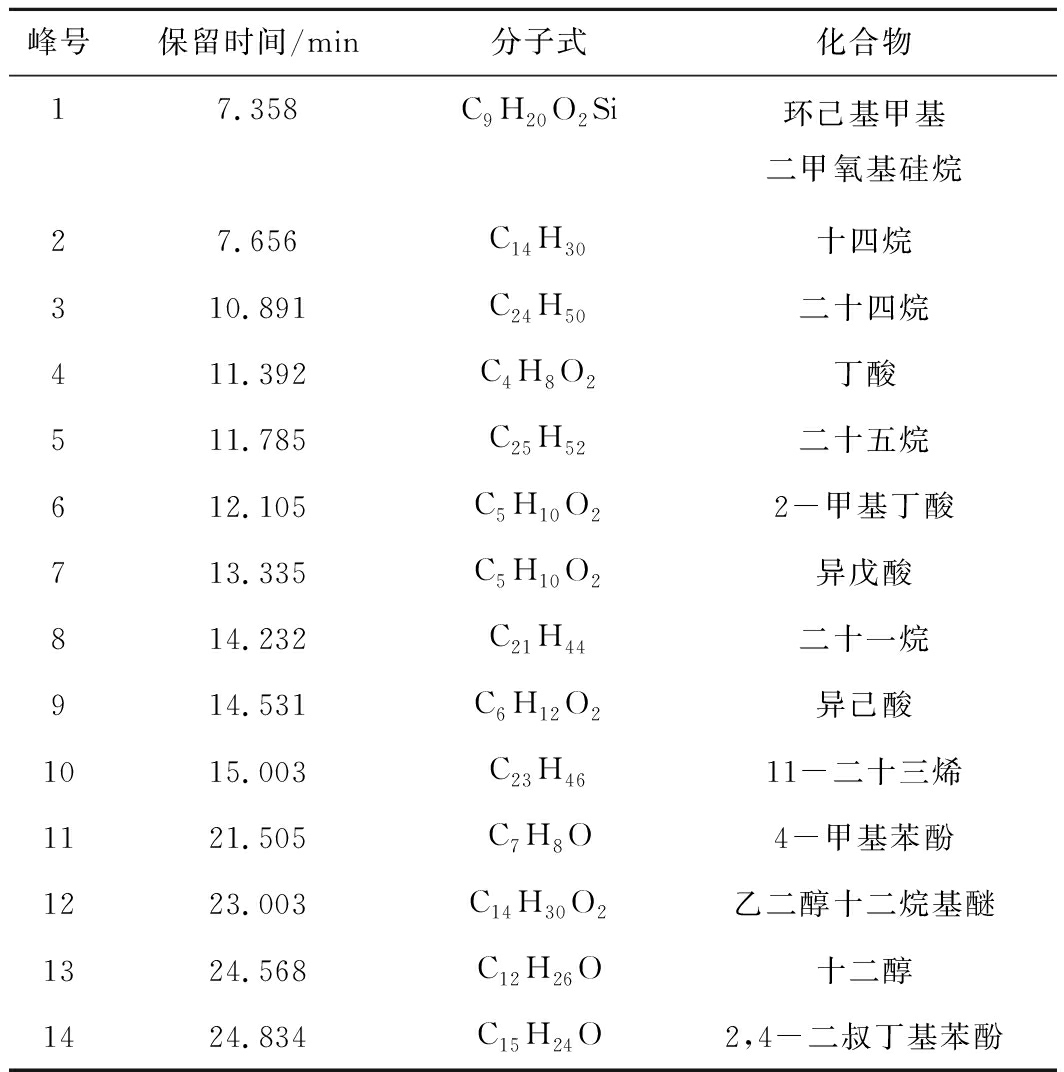
峰号保留时间/min分子式化合物17.358C9H20O2Si环己基甲基二甲氧基硅烷27.656C14H30十四烷310.891C24H50二十四烷411.392C4H8O2丁酸511.785C25H52二十五烷612.105C5H10O22-甲基丁酸713.335C5H10O2异戊酸814.232C21H44二十一烷914.531C6H12O2异己酸1015.003C23H4611-二十三烯1121.505C7H8O4-甲基苯酚1223.003C14H30O2乙二醇十二烷基醚1324.568C12H26O十二醇1424.834C15H24O2,4-二叔丁基苯酚
长焰煤试验组试验开始阶段(第0天)就有大分子物质存在,与在发酵第10天化合物含量有较大变化,部分芳香环和杂环化合物丰度降低,VFA和甲基化合物等物质的丰度升高,如丁酸、戊酸等,而VFA被认为是生物甲烷产生的前提,甲基类物质可以通过甲基营养途径参与成气,说明该阶段的发酵液具有较大的产气潜力。在发酵第15天有新的大分子物质产生,如2,4-二叔丁基苯酚(14号峰)等,这可能缘于水解菌的降解。在第20天并未检测到大量的VFA及低分子化合物,可能由于随着产甲烷菌群对发酵环境逐步适应,其活性增强,对VFA等低分子物质的消耗速率大于生成速率,并且对比第20天与第15天,所有化合物(包括芳香环和杂环化合物)均处于下降状态,这一阶段微生物降解剧烈,这可能是这个期间出现产气高峰的原因,这与Orem等学者的研究结果相似[28]。第30天期间化合物丰度出现上升趋势,但产气幅度不大,可能是前期部分水解菌活性降低,有机大分子物质不能充分被利用。
焦煤试验组发酵过程液相产物变化特征基本上与长焰煤组相似,但之间仍有差异,焦煤试验组第10天,代谢产物中芳香环和杂环化合物分子量相对较小,原因是在排除微生物降解发酵底物的可能性条件下,焦煤较长焰煤变质程度大,不易被微生物降解,得到的长链烷烃分子量相对较小。在发酵第15天同时又有大分子物质产生,如正二十一烷(10号峰)、正三十烷(13号峰),并且十九烯(12号峰)丰度增长较大,较长焰煤试验组,新生成的长链烷烃分子量较大,表明微生物已经对焦煤进行降解(表3)。
表3 焦煤厌氧发酵过程中GC-MS半定性结果
表3 GC-MS qualitative results in process of anaerobicfermentation for coking coal
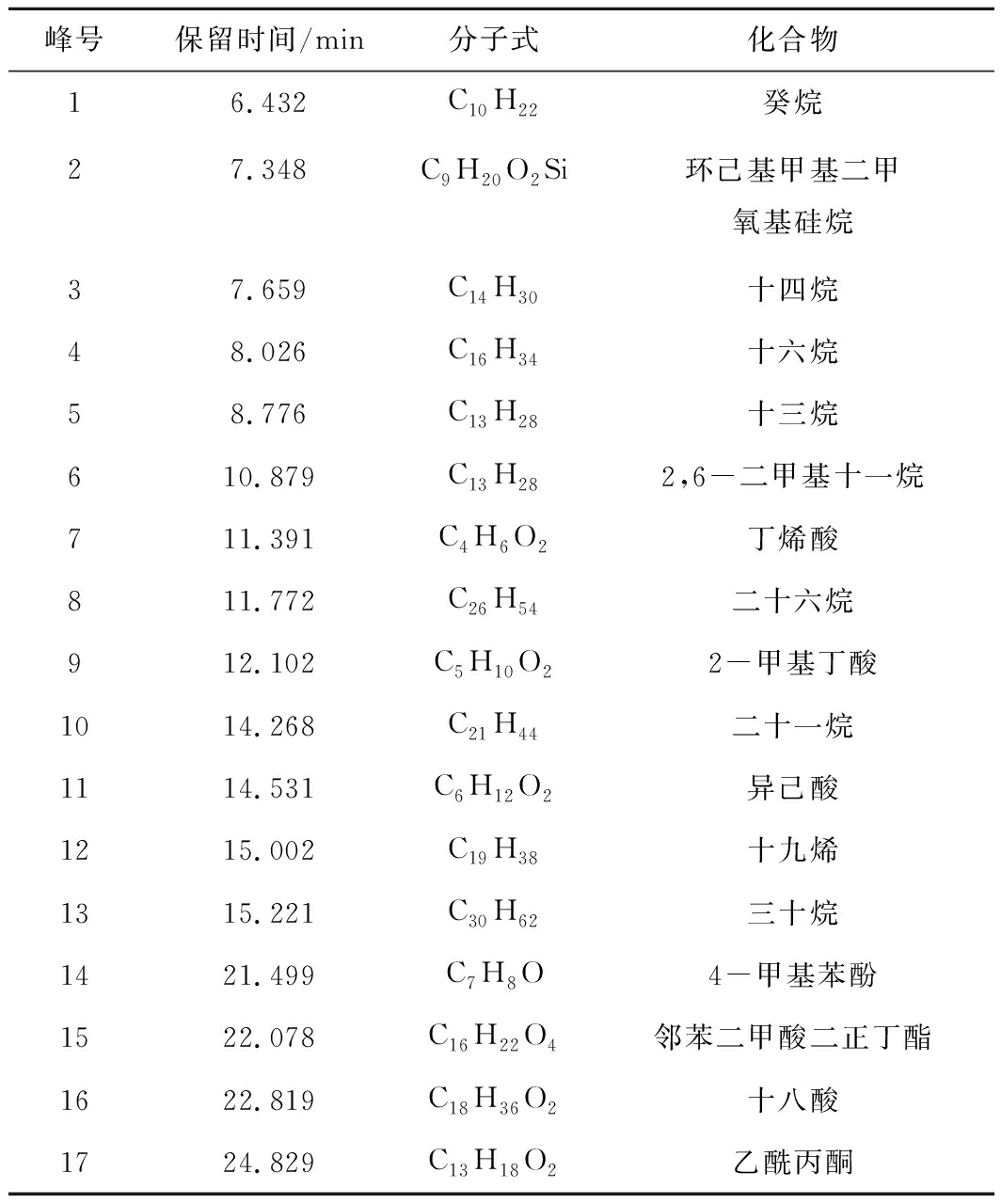
峰号保留时间/min分子式化合物16.432C10H22癸烷27.348C9H20O2Si环己基甲基二甲氧基硅烷37.659C14H30十四烷48.026C16H34十六烷58.776C13H28十三烷610.879C13H282,6-二甲基十一烷711.391C4H6O2丁烯酸811.772C26H54二十六烷912.102C5H10O22-甲基丁酸1014.268C21H44二十一烷1114.531C6H12O2异己酸1215.002C19H38十九烯1315.221C30H62三十烷1421.499C7H8O4-甲基苯酚1522.078C16H22O4邻苯二甲酸二正丁酯1622.819C18H36O2十八酸1724.829C13H18O2乙酰丙酮
瘦煤发酵过程液相产物变化特征较长焰煤试验组、焦煤试验组有所不同,同样易挥发性脂肪酸(VFA)和甲基化合物等物质(丁酸、苯酚、4-甲基戊酸、2-甲基丁酸)在第10天的丰度有所升高(图4、表4),但从以后的样品GC-MS测试结果来看,部分VFA从生成就无法被充分利用,说明在瘦煤的煤制甲烷试验过程中菌群活性较长焰煤与焦煤试验组的要低,从而使得VFA的降解速率小于生成速率,这也是瘦煤试验组产甲烷量低的原因之一。
表4 瘦煤生物制气发酵液GC-MS半定性结果
Table 4 GC-MS qualitative results in process ofanaerobic fermentation for lean coal
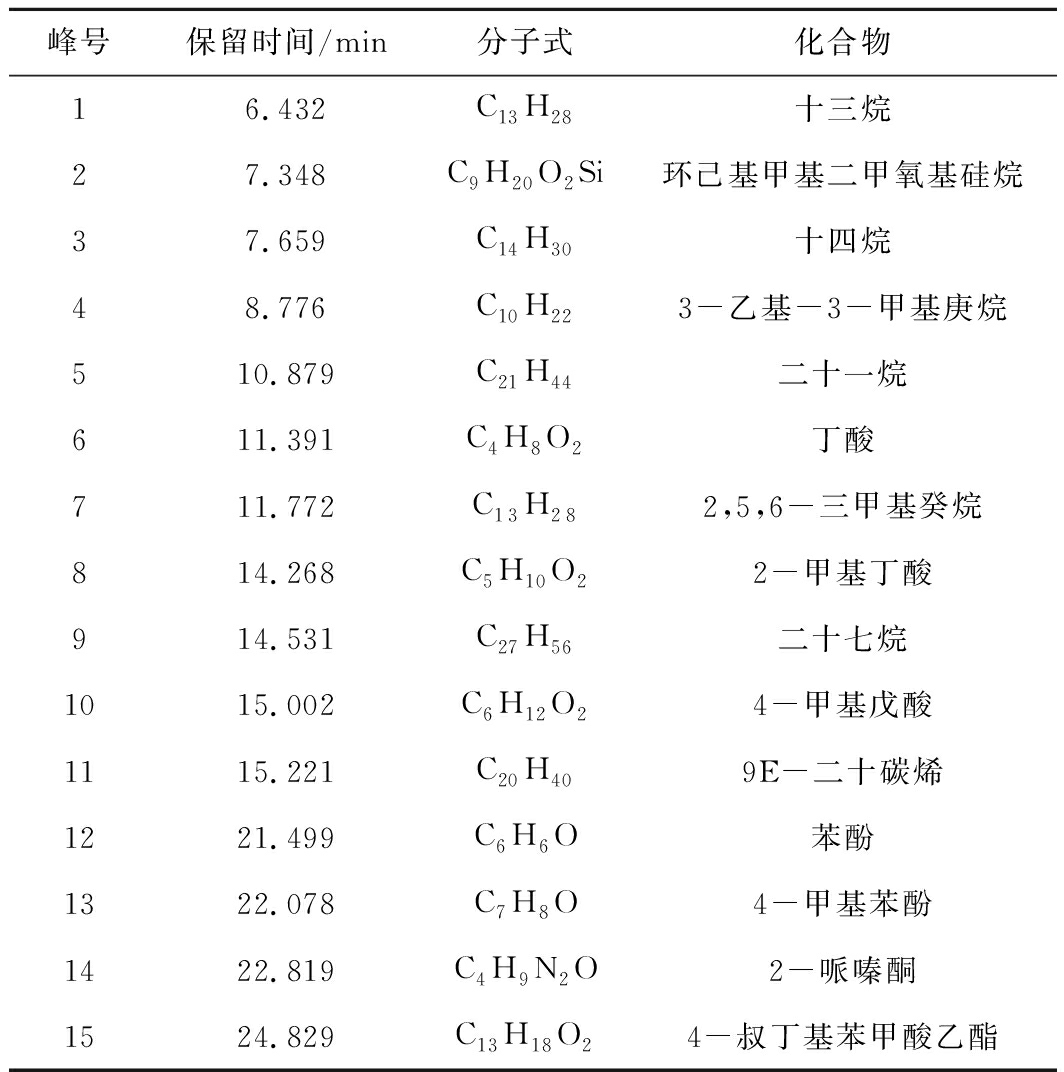
峰号保留时间/min分子式化合物16.432C13H28十三烷27.348C9H20O2Si环己基甲基二甲氧基硅烷37.659C14H30十四烷48.776C10H223-乙基-3-甲基庚烷510.879C21H44二十一烷611.391C4H8O2丁酸711.772C13H282,5,6-三甲基癸烷814.268C5H10O22-甲基丁酸914.531C27H56二十七烷1015.002C6H12O24-甲基戊酸1115.221C20H409E-二十碳烯1221.499C6H6O苯酚1322.078C7H8O4-甲基苯酚1422.819C4H9N2O2-哌嗪酮1524.829C13H18O24-叔丁基苯甲酸乙酯
前人研究结果表明,煤层水中或煤的可有机提取物中存在长链烷烃、类异戊二烯和多种长链脂肪类和饱和烃类化合物(如本研究的二十四烷、二十五烷、二十一烷等)[29],同时在煤层气井排采水中检测到的单甲基烷烃和烷基环己烷是典型的微生物降解煤的产物[30],脂肪族化合物和环状碳氢化合物可能是煤层水中生物降解脂肪酸等物质的结果[31]。一些研究结果表明,低成熟度煤中存在低分子量水溶性有机物,在这些研究中,主要的可提取化合物及其浓度取决于煤的成熟度,一些发酵中间产物(如脂肪酸)具有潜在毒性或抑制甲烷的生成[32]。甲烷生成的抑制可能与通过有机酸中间体的积累降低酸碱度有关。焦煤试验组检测到的脂肪酸(十八酸)丰度较大,可抑制甲烷的生成,这可能是焦煤试验组相较长焰煤试验组甲烷产量低的原因之一。同时福莫罗等[29]对低阶煤和高阶煤的提取物进行的研究表明,在地下煤炭生态系统中,芳烃的生物降解优先于脂肪类物质。长焰煤试验组中多环芳烃及其功能衍生物(如2,4-二叔丁基苯酚)丰度较焦煤试验组(如邻苯二甲酸二正丁酯)和瘦煤试验组(如苯酚)高的多,更适合微生物降解,产生更多的生物甲烷。
2.3 煤表面菌群吸附特征
为了观察不同煤阶煤发酵体系中煤样表面微生物群落和浮游微生物群落的附着规律,进行了扫描电镜试验,结果如图5所示。试验依次从3个阶段(第10天、第15天和第20天)概述了菌群的形态类型、附着方法以及煤表面的变化特征。

图5 不同煤样厌氧发酵过程中煤表面结构变化特征
Fig.5 Change characteristics of coal surface structure in process of anaerobic fermentation for different coal samples
第10天,在3种类型煤样表面均观察到细胞的存在,但存在的形态类型不同。长焰煤表面存在球状细胞(长0~0.8 μm)和杆状细胞(长1~2 μm),但主要以球状为主。焦煤表面存在棒状的异型体(长0~1.2 μm)和杆状黏附细胞(长2~3 μm),分布较单一,没有出现群居分布。瘦煤表面细胞也由单一球状(长0~0.8 μm)结构形态组成。
第15天,长焰煤表面观察到与第10天相同形态的细胞,没有明显的附着迹象,但数量增加,偶尔出现菌丝包裹球状细胞的现象。焦煤在第15天棒状的异型体细胞密度增加(长0.8~1.2 μm),同样也没有明显的附着迹象。而在瘦煤表面观察到一种新的形态(长2~3 μm),并对煤样的黏附性较大,偶尔与球状细胞相互交融。大体在第15天细胞密度均有所增加,细菌的活性在10~15 d增长较快。
在发酵末期(第20天),长焰煤表面细丝状形态明显,但球状和杆状细胞密度减少。焦煤表面偶尔能观察到杆状粘附细胞,发酵分泌物分布较大,整体较第15天细胞密度有所减少。最后,焦煤和瘦煤表面均发现有细胞裂解现象,说明在第20天细菌陆续死亡,致使发酵体系开始减弱。
观察不同天数下煤样表面的变化特征,发现长焰煤表面凹凸不平,粗糙度逐渐增加,侧面反映出长焰煤被菌群充分降解。而焦煤和瘦煤表面发酵分泌物增多,但表面结构无明显变化,所以相较于长焰煤,焦煤和瘦煤煤阶较高,很难被微生物利用。
一些学者对煤层微生物群落结构进行了活性监测,发现相较于煤层水,附着在煤固体上的微生物更多,所以观察煤表面的菌群分布更能反映煤生物发酵过程中菌群结构的变化规律。长焰煤试验组液相产物中生成的VFA较多,对发酵不利的细菌源Desulfovibrio(脱硫弧菌)和Pseudomonas(假单胞菌)菌为杆状菌[33],因此球状菌可能是对发酵有利的水解菌与乙酸营养型产甲烷菌,它们较高的吸附率验证了长烟煤组产甲烷量高的事实[34],所以在长焰煤试验组观察到的菌群分布多为球状菌。发酵过程中CO2生成量与液相产物分子量成正比关系这一结论已被证实,并且焦煤试验组生物降解焦煤产生的甲基类物质和大分子脂肪烃物质丰度较大,因此在焦煤试验组中可能以还原CO2为代谢途径的Methanobacterium(甲烷杆菌属)[35]含量较多,与图5焦煤试验组SEM图像相匹配。瘦煤试验组甲基类物质与VFA含量较丰富,因此与长烟煤组电镜结果相似,以球状菌为主,也可能存在以还原CO2为代谢途径的Methanobacterium,但两者相对含量较低,与瘦煤试验组SEM测试结果相符,甲烷产量相对较低。由此可以看出,液相产物可以间接表征煤样表面菌群的吸附特征,为煤制生物甲烷过程中微生物的分布特征研究提供借鉴。
3 结 论
1)生物产气总量与煤阶成反比,煤阶越高,生物产气总量越低,并且低煤阶煤的生物甲烷产量明显高于高煤价煤,说明低阶煤更适合作为碳源供产甲烷菌利用。
2)3个煤阶的煤生物产气过程的第10天有VFA和甲基化合物等物质生成,长焰煤试验组与焦煤试验组在产气高峰期(第15天)未检测到VFA等小分子物质存在,并且伴随有新的大分子物质生成,而瘦煤试验组并未在第15天检测到VFA,可能归因于瘦煤试验组发酵后期产甲烷菌活性的降低。
3)液相产物可以间接表征煤样表面菌群的吸附特征。在发酵第10天,均检测到菌群细胞的存在,但存在的形态类型不同;在发酵第15天,细胞密度均有所增加;在发酵第20天,长焰煤表面球状和杆状细胞密度减少,焦煤和瘦煤表面发现有细胞裂解现象。
4)长焰煤表面凹凸不平,粗糙度逐渐增加,而焦煤和瘦煤表面结构无明显变化。
[1] EDENHOFER O, MADRUGA R P, SOKONA Y, et al.Renewable energy sources and climate change mitigation:special report of the Intergovernmental panel on climate change[M]. Cambridge University Press,2011.
[2] SAXENA R C, ADHIKARI D K, GOYAL H B. Biomass-based energy fuel through biochemical routes:A review[J]. Renewable and Sustainable Energy Reviews, 2009, 13(1):167-178.
[3] PARK S Y, LIANG Y. Biogenic methane production from coal:a review on recent research and development on microbially enhanced coalbed methane (MECBM) [J]. Fuel,2016,166:258-267.
[4] STRAPOCD, PICARDAL F W, TURICH C,et al. Methane-producing microbial community in a coal bed of the Illinois Basin [J]. Applied and Environmental Microbiology, 2008, 74(8):2424-2432.
[5] OREM W H, VOYTEK M A, JONES E J, et al. Organic intermediates in the anaerobic biodegradation of coal to methane under laboratory conditions[J]. Organic Geochemistry,2010,41(9):997-1000.
[6] 董志伟, 郭红玉, 夏大平, 等. 基于显微CT的煤生物降解过程中孔隙演化精细表征[J]. 煤田地质与勘探, 2019, 47(5):63-69.
DONG Zhiwei, GUO Hongyu, XIA Daping, et al. Micro CT-based meticulous characterization of porosity evolution of coal in the process of biodegradation[J]. Coal Geology & Exploration, 2019, 47(5):63-69.
[7] PAPENDICK S L, DOWNS K R, VO K D, et al. Biogenic methane potential for Surat Basin, Queensland coal seams [J]. International Journal of Coal Geology, 2011, 88(2-3):123-134.
[8] BECKMANN S, LUEDERS T, KRÜGER M, et al. Acetogens and acetoclastic methanosarcinales govern methane formation in abandoned coal mines [J]. Applied and Environmental Microbiology, 2011, 77(11):3749-3756.
[9] LIU D Y, TAGO K, HAYATSU M, et al. Effect of elevated CO2 concentration, elevated temperature and no nitrogen fertilization on methanogenic archaeal and methane-oxidizing bacterial community structures in paddy soil[J]. Microbes and Environments, 2016, 31(3):349-356.
[10] ÜNAL B, PERRY V R, SHETH M, et al. Trace elements affect methanogenic activity and diversity in enrichments from subsurface coal bed produced water[J]. Frontiers in Microbiology, 2012, 3(175):1-14.
[11] 苏现波, 徐 影, 吴 昱, 等. 盐度、pH对低煤阶煤层生物甲烷生成的影响[J]. 煤炭学报, 2011, 36(8):1302-1306.
SU Xianbo, XU Ying, WU Yu, et al. Effect of salinity and pH on biogenic methane production of low-rank coal[J]. Journal of China Coal Society, 2011, 36(8):1302-1306.
[12] STRAPOC D, MASTALERZ M, DAWSON K, et al. Biogeochemistry of microbial coal-bed methane[J]. Annual Review of Earth and Planetary Sciences, 2011, 39(1):617-656.
[13] 宋金星, 郭红玉, 陈山来, 等. 煤中显微组分对生物甲烷代谢的控制效应[J]. 天然气工业, 2016, 36(5):25-30.
SONG Jinxing, GUO Hongyu, CHEN Shanlai, et al. Control effects of coal maceral composition on the metabolism of biogenic methane[J]. Natural Gas Industry, 2016, 36(5):25-30.
[14] WAWRIK B, MENDIVELSO M, PARISI V A, et al. Field and laboratory studies on the bioconversion of coal to methane in the San Juan Basin[J]. FEMS Microbiology Ecology, 2012, 81(1):26-42.
[15] 陈林勇, 王保玉, 邰 超, 等. 无烟煤微生物成气中间代谢产物组成及其转化[J]. 煤炭学报, 2016, 41(9):2305-2311.
CHEN Linyong, WANG Baoyu, TAI Chao, et al. Composition and conversion of intermediate products in the process of anthracite gasification by microorganism[J]. Journal of China Coal Society, 2016, 41(9):2305-2311.
[16] 赵同谦, 李 鹏, 邰 超, 等. 煤生物成气过程中溶解性有机物的光谱特征研究[J]. 煤炭学报, 2017, 42(2):525-534.
ZHAO Tongqian, LI Peng, TAI Chao, et al. Spectral characteristics of dissolved organic matter in the process of coal gasification by microorganism[J]. Journal of China Coal Society, 2017, 42(2):525-534.
[17] XIA D P, ZHANG H W, SU X B, et al. Adsorption and Heat Characteristics of Coal-Microorganisms during the Cogeneration of H2 and CH4 Following Pretreatment with White Rot Fungi[J]. Journal of Cleaner Production, 2020, 255:120242.
[18] 杨 敏. 微生物胞外聚合物的生成及其对树脂特性的影响研究[D]. 昆明:昆明理工大学, 2012.
YANG M. The generation of microbial extracellular polymeric substances and its influence on resin characteristic[D]. Kunming: Kunming University of Science of Technology, 2012.
[19] GUO H Y, DONG Z W, LIU XL, et al. Analysis of methanogens adsorption and biogas production characteristics from different coal surfaces[J]. Environmental science and Pollution Research, 2019, 26(14):13825-13832.
[20] RAO K H, SUBRAMANIAN S.Bioflotation and bioflocculation of relevance to minerals bioprocessing[M]. Microbial processing of met al sulfides. 2007.
[21] MITTAL A K, VENKOBACHAR C. Sorption and desorption of dyes by sulfonated Coal[J]. Journal of Environmental Engineering, 1993, 119(2):366-368.
[22] PARSEK M R, SINGH P K. Bacterial biofilms:an emerging link to disease pathogenesis[J]. Annual Review of Microbiology, 2003, 57(1):677-701.
[23] HURLOW J, COUCH K, LAFORET K, et al. Clinical biofilms:a challenging frontier in wound care[J]. AdvWoundCare (New Rochelle), 2015, 4(5):295-301.
[24] VICK S H W, TETU S G, SHERWOOD N, et al. Revealingcolonisation and biofilm formation of an adherent coal seam associated microbial community on a coal surface[J]. International Journal of Coal Geology, 2016, 160-161:42-50.
[25] SCHLEGEL M E, MCINTOSH J C, PETSCH S T,et al. Extent and limits of biodegradation by in situ methanogenic consortia in shale and formation fluids[J]. Applied Geochemistry, 28(28):172-184.
[26] GUO H G, CHENG Y T, HUANG Z X, et al. Factors affecting co-degradation of coal and straw to enhance biogenic coalbed methane[J]. Fuel, 2019, 244:240-246.
[27] KASEMETS K, KOSAAR S, VIJA H, et al. Toxicity of differently sized and charged silver nanoparticles to yeast Saccharomyces cerevisiae BY4741:a nano-bio interaction perspective[J]. Nanotoxicology, 2019, 13(8):1-40.
[28] OREM W H, VOYTEK M A, JONES E J, et al. Organic intermediates in the anaerobic biodegradation of coal to methane under laboratory conditions[J]. Organic Geochemistry, 2010, 41(9):997-1000.
[29] FORMOLO M, MARTINI A, PETSCH S. Biodegradation of sedimentary organic matter associated with coalbed methane in the Powder River and San Juan Basins, U.S.A[J]. International Journal of Coal Geology, 2008, 76(1-2):86-97.
[30] KENIG F. C16-C29 homologous series of monomethylalkanes in the pyrolysis products of a Holocene microbial mat[J]. Organic Geochemistry, 2000, 31(2):237-241.
[31] WAWRIK B, MENDIVELSO M, PARISI V A, et al. Field and laboratory studies on the bioconversion of coal to methane in the San Juan Basin[J]. FEMS Microbiology Ecology, 2012, 81(1): 26-42.
[32] JONES E J P, VOYTEK M A, WARWICK P D, et al. Bioassay for estimating the biogenic-generating potential of coal samples[J]. International Journal of Coal Geology, 2008, 76:138-150.
[33] GUO H Y, ZHANG M L, DONG Z W, et al. The mechanisms of biogenic methane metabolism by synergistic biodegradation of coal and corn straw[J]. Bioresource Technology, 2020, 298:122577.
[34] DEPPENMEIER U, JOHANN A, HARTSCH T, et al. The genome of Methanosarcina mazei:evidence for lateral gene transfer between bacteria and archaea[J]. Journal of Molecular Microbiology & Biotechnology, 2002, 4(4):453-461.
[35] MA K, LIU X L, DONG X Z. Methanobacterium beijingense sp. nov. a novel methanogen isolated from anaerobic digesters[J]. International Journal of Systematic & Evolutionary Microbiology, 2005, 55(1):325-329.
